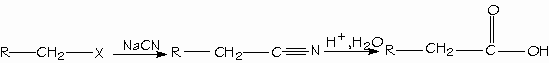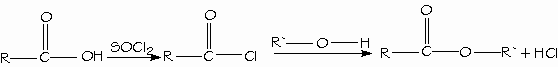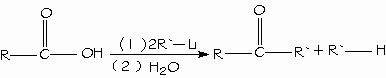¿QUE SON LOS ALCOHOLES?
Son aquellos compuestos orgánicos en cuya estructura se encuentra el grupo hidroxilo (-OH), unido a un carbono que solo se acopla a otro carbono o hidrógenos.
Pueden ser alifáticos (R-OH) o aromáticos (Ar-OH) estos últimos se conocen como fenoles.
Son un grupos de compuestos muy importantes, no solo por su utilidad industrial, de laboratorio, teórica, o comercial, si no también, porque se encuentran muy extensamente en la vida natural.
Cuando en la molécula del alcohol hay mas de un grupo hidroxilo se les llama polioles o alcoholes polihídricos. Si son dos grupos hidroxilos se llaman glicoles, tres,gliceroles, cuatro tetrioles y así sucesivamente.
¿QUÉ HAY CON LA NOMENCLATURA?
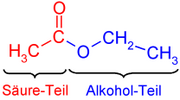
Es común que los alcoholes se nombren usando la palabra alcohol como nombre, y con el "apellido" del grupo correspondiente a los alcanos básicos que le dan lugar, esta nomenclatura se ilustra a continuación.
También existe la denominación de la IUPAC (International Union of Pure and Applied Chemistry) que resulta necesaria para los alcoholes con estructura mas compleja.
Según la IUPAC para nombrar los alcoholes se utiliza la terminación -ol al final de la nomenclatura raíz del homólogo correspondiente de los alcanos. Por ejemplo:
| CH4 | CH3OH |
| Metano | Metanol |
|
|
| CH3CH3 | CH3CH2OH |
| Etano | Etanol |
Esta nomenclatura de la IUPAC es particularmente útil para los alcoholes mas complejos, así tenemos que la posición del grupo hidroxilo (-OH) se señala con un número, este número corresponde al carbono de la cadena recta mas larga encontrada, y contado a partir del extremo mas cercano al carbono que tiene el grupo hidroxilo.
Los alcoholes también pueden tener anillos cerrados en la estructura, en este caso se les coloca el prefijo ciclo delante del nombre.
A su vez los alcoholes pueden ser primarios, secundarios o terciarios, en dependencia de la cantidad de carbonos acoplados a aquel que tiene el grupo hidroxilo.
ejemplos.
Propiedades físicas de los alcoholes.
El punto de fusión y ebullición de los alcoholes, como en los hidrocarburos, crece con el aumento del tamaño de la molécula.
En términos generales los alcoholes con 12 o menos átomos de carbono en la estructura son líquidos a temperatura ambiente, ya con mas de 12 son sólidos.
La solubilidad en agua (con raras excepciones) se reduce con el aumento del peso molecular, de esta forma, el metanol, etanol y propinol son solubles en agua en cualquier proporción, a partir de 4 o mas átomos de carbono la solubilidad comienza a disminuir de modo que, a mayor peso molecular, menor solubilidad.
Fuentes naturales y usos de los alcoholes.
Durante la destilación del petróleo se recuperan ciertas cantidades de mezclas de alcoholes en el rango C3 hasta C5, que se utilizan principalmente como materias primas para la producción de otros compuestos.
Se obtienen alcoholes diversos también como subproductos de procesos de síntesis de otros compuestos orgánicos.
Cantidades importantes de glicerina, un alcohol con tres grupos hidroxilo, se obtienen en la saponificación de las grasas naturales para la producción de jabón. La glicerina se usa extensamente en la preparación de cremas y productos cosméticos.
Durante la fermentación natural de soluciones dulces, (melazas o azúcares en agua, jugo de frutas dulces, etc.) se puede obtener una disolución de etanol hasta del 12% de concentración, que luego puede ser concentrada por destilación directa hasta el 95%. En condiciones especiales o con el uso de sales deshidratadoras puede incluso aumentarse la concentración hasta obtener etanol técnicamente puro.
Los mostos, desechos de la destilación primaria para la separación del etanol, contienen diferentes tipos de alcoholes superiores y fenoles que pueden ser separados.
Del proceso de destilación seca de la madera para obtener carbón vegetal se pueden recuperar cantidades importantes de metanol, por este motivo el metanol se conoce también como alcohol de madera.
Los alcoholes primarios saturados de cadena recta en el rango C12 - C18, son muy importantes en la facturación de detergentes y se obtienen de la hidrogenación de las grasas naturales.
Propiedades químicas de los alcoholes.
Los alcoholes pueden reaccionar de manera que retengan el oxígeno o que lo pierdan. Son bastante reactivos y sus reacciones básicas son las siguientes:
Reacción con los metales alcalinos y alcalinos-térreos.
Los alcoholes reaccionan con estos metales igualmente como lo hace el agua, pero con menos violencia, para formar lo que se conoce como alcóxidos (equivalentes a los hidróxidos que forma el agua).
Na + CH3CH2OH ---------------> CH3CH2ONa + ½H2
Los alcoholes primarios reaccionan con mas fuerza que los secundarios, y estos a su vez, con más que los terciarios.
Reacción con los ácidos.
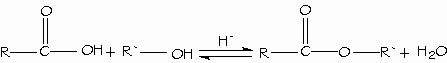
Los alcoholes reaccionan con los ácidos orgánicos e inorgánicos fuertes para formar los ésteres. Los ésteres obtenidos de ácidos inorgánicos es frecuente encontrarlos como ésteres inorgánicos.
CH3OH + SO4H2 ---------------> CH3O-SO2-OCH3Metanol + Ácido sulfúrico -----------------> Sulfato de metilo.
Des hidrogenación de los alcoholes.
Los alcoholes primarios y secundarios cuando se calientan en contacto con ciertos catalizadores, pierden átomos de hidrógeno para formar aldehídos o cetonas. Si esta deshidrogenación se realiza en presencia de aire (O) el hidrógeno sobrante se combina con el oxígeno para dar agua.







.jpg)
.jpg)
.jpg)
.jpg)
.jpg)

.jpg)
.jpg)